Aminler - Wikipedia
Aminlər – üzvi birləşmələr olub, molekulunda bir, iki və ya üç hidrogen atomunun karbohidrogenlə əvəz olunmuş amonium törəmələridir.
CH3NH2 - metilamin (birli)
(CH3)2NH - dimetilamin (ikili)
(CH3)3N - trimetilamin (üçlü)
| Metiamin (birli) | Dimetilamin (ikili) | Trimetilamin (üçlü) |
|---|---|---|
 |
 |
 |
Növləri
redaktəAzotla əlaqəli olan üzvi qrupun xassələrinə görə aminlər üç yerə bölünür:
- Alifatik aminlər - CH3-N<
- Aromatik aminlər - C6H5-N<
- Yağlı aromatik aminlər (tərkibində aromatik və alifatik radikallar vardır)
NH2-qrupun sayına görə aminlər monoaminlər,diaminlər və triaminlərə və s. bölünürlər.
Aminlərin quruluşlarının özünəməxsusluğu
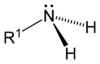
redaktəAzot atomunun elektron konfiqurasiyasından 1s22s22p3 göründüyü kimi o, məsələn hidrogen atomu ilə üç kovalent rabitəni (NH3) əmələ gətirə bilir. Bundan başqa azot 2s-elektronları hesabına digər hissəciyin (məsələn H+) vakant orbitləri hesabına donor-akseptor mexanizminə uyğun dördüncü kovalent rabitə əmələ gətirə bilir.
Ammonyak molekulunda olduğu kimi aminlərdə (NR1R2R3) də azot atomu tetraedrik piramidanın təpələrində yerləşmişdir. Rabitələrin bucaqları tetraedrik (~108o) olmaqla azot atomunun daha bir çütləşmiş sərbəst elektronları vardır.
Tetraedrik rabitə bəzən pozulur, məsələn üçüzvlü etilamində bananabənzər qövsvari rabitə əmələ gəlir.
Azot atomunda heç olmazsa bir aromatik əvəzləyici varsa (məsələn, anilində) rabitə bucağı güclü dıyişir. Bu bucaqları 120o -yə yaxın olan piramida daha çox müstəvi xarakterlidir. Trifenilaminmetanda bucaq 120o olduğundan molekulu demək olar ki, müstəvi üzərindədir. Bu onunla əlaqədardır ki, anilin molekulunda azotun qoşulmuş elektron cütləri benzol nüvəsi ilə qarşılıqlı təsirdə olur və trifenilamində bu təsir üç dəfə böyük olduğundan onu daha güclü büruzə verir.
Azot (xlor kimi) elektromənfiliyinə görə flüor və oksigendən sonra üçüncü element olduğundan o, amin qrupuna daha çox elektromənfilik (-J effekt) verir. Bununla əlaqədar olaraq, azot atomu amin molekulunu nəzərə çarpacaq dərəcədə polyarlaşdırır və nəticədə zəif molekullararası hidrogen rabitəsinin əmələ gəlməsinə imkan verir.
Alınması
redaktəAminlərin alınması (Zinin reaksiyası) nitrobirləşmərin reduksiyasına əsaslanır:
- C6H5NO2 +3(NH4)2S→C6H5NH2 + 6NH3 +3S + 2H2O
Bu reaksiya 1842-ci ildə N.N.Zinin tərəfindən aparılıb. Bu reaksiyada o, nitrobenzola ammonium sulfidlə təsir edib və anilin almışdır. Eləcə də Dəmirlə reduksiya etməklə:
- 4 C6H5NO2 +9Fe + 4H2O→ 4C6H5NH2 + 3Fe3O4
Yüksək temperaturda katalizator iştirakı ilə hidrogenlə reduksiya etməklə:
- C6H5NO2 +3H2→ C6H5NH2 + 2H2O
aminləri almaq olar.
Aminlərin fiziki xassələri
redaktəBeləliklə, birli aminlər polyar birləşmələr olmaqla, onlar moklekullararası hidrogen rabitəsini əmələ gətirirlər. düzdür, bu birli və ikili aminlərə aiddir, çünki üçlü aminlərdə azot azot atomuna birləşmiş hidrogen atomu olmadığından hidrogen rabitəsi yarana bilmir.
Bununla əlaqədar olaraq, eyni molekul çəkisinə malik olan digər üzvi birləşmələrə nisbətən aminlər yüksək temperaturda qaynayırlar. Ancaq, aminlərin qaynama temperaturu analoji turşu və spirtlərin qaynama temperaturundan aşağıdır. Metilaminlər (metilamin, dimetilamin, trimetilamin) qazdır, etilamin 17o -də, propilamin isə 47o -də qaynayan mayedir. Şox karbonu olan aminlər daha yüksək dərəcədə qaynayan maye və ya bərk maddələrdir. Kiçik molekul çəkili birli və ikili aminlər suda yaxşı həll olurlar. Metilaminlər (CH3NH2, (CH3)NH, (CH3)3N) ammonyaka oxşar iyli qazdır. Yüksək molekullu aminlər balıq iyi verirlər.
Aromatik aminlər nisbətən xoş iylidirlər. lakin onlar da, olduqca zəhərli olmaqla, asanlıqla dəridən sovrulur. Bir çox aromatik aminlər konseragen (xərçəng xəstəliyi törədən) maddələrdir, məsələn: β- naftilamin və benzidin.
Kimyəvi xassələri
redaktəKimyəvi cəhətdən aminlər əsas xassəli olub, indikatorlara təsir edir və turşularla duzlar əmələ gətirir. Aminlər əsaslıq qüvvəsinə görə ammoniakdan daha qüvvətlidir. Amin molekulunda alkillərin miqdarının artması ilə onlar daha qüvvətli əsas xassəsi kəsb edir, ikili aminlər müvafiq birli aminlərdən, üçlülər də ikililərdən qüvvətli əsas olur. Kiçik molekul kütləsinə malik olan aminlər qaz, molekul kütləsi artdıqca maye ,zəncirin uzunluğu artdıqca (R=10) bərk halda olur.Ammonyakın iyinə bənzər iyi var. Bəzi aminlər toksik xassələrə malikdir. Anilin dəriyə düşdükdə qanın tərkibindəki hemoqlabinə təsir edir. Bu zaman barmaqların, burnun, dodaqların göyərməsi baş verir. Zədələnmiş dəriyə spirt məhlulu qoymaq və zərərçəkəni havaya çıxarmaq lazımdır. Alifatik aminlər əsəb sisteminə təsir edir.Bəzi aromatik aminlər sidik qişasının xərçənginə səbəb olur. Alifatik aminlər su ilə reaksiyaya daxil olurlar və alkilammonium hidroksidi əmələ gətirir:
- C6H5NH2 + 2H2O→[C6H5NH3]OH
Turşularla reaksiyaya daxil olur və suda həll olan alkilammonium duzları əmələ gətirir:
- CH3CH2NH2 +HCl → [CH3CH2NH3]Cl
Aminlərə asetonun halogen törəmələri ilə təsir etdikdə asetanilid əmələ gəlir ki, bu da istiliyi azaldır.
- C6H5NH2+ CH3COCl→ C6H5NH(COCH3) +HCl
Aminlər qızdırıldıqda sudan başqa karbon qazı və azot ayrılır:
- 4CH3NH2 + 9O2→2N2 + 4CO2 +10H2O
Tətbiqi
redaktəAlifatik diaminlərdən polimer plyonkalar, neylonistehsalında, maşınqayırmada istifadə edilir. Eyni zamanda ayaqqabıaltı podoşlar,poliuretan yapışqanları istehsalında tətbiq eilir. Sulfanil turşuları əsasında sətəlçəmə qarşı dərman istehsal edilir.Fotohəssas materialların istehsalında işlədilir.
Aminlərpraktiki cəhətdən mühüm xassələrə malik üzvi maddələrdir. Onlardan boyaqlar və dərman preparatları, plastik kütlələr alınır. Bitki mənşəli heterotsiklik aminlər (alkaloidlər) yeyinti sənayesində, əczaçılıqda istifadə edilir. Sosial təhlükəli preparatlar: kofein, xinin, morfolin, nikotin, kokain, papaverin və s. da bu qəbildəndir.
Mənbə
redaktə- Кнунянц И. Л. и др. т.1 А-Дарзана // Химическая энциклопедия. — М.: Советская энциклопедия, 1988. — 623 с. — 100 000 экз.
- Грандберг И.И. Органическая химия. Дрофа, 2003
- О. С. Габриелян и др. Химия 10 кл. М., Дрофа, 2002;
- Л. С. Гузей, Р. П. Суровцева, Г. Г. Лысова. Химия 11 кл. Дрофа, 1999.
- Г. Г. Лысова. Опорные конспекты и тесты по органической химии. М., ООО "Глик плюс", 1999.
- Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 10 кл. М., Просвещение, 2001.
- S.F.Qarayev, U.B.İmaşev, G.M.Talıbov "Üzvi kimya", Bakı-2003.

